Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Ряд напряжений - определение
Электрохимический ряд напряжения металлов; Ряд активности металлов; Ряд напряжений; Электрохимический ряд напряжений; Таблица стандартных электродных потенциалов; Законы Вольта; Ряд стандартных электродных потенциалов
Найдено результатов: 132
РЯД НАПРЯЖЕНИЙ
(ряд активностей) в электрохимии , последовательность расположения металлов в порядке возрастания значений из стандартного потенциала (за нуль принят потенциал водорода). Ряд напряжений некоторых металлов: К, Са, Mg, Al, Zn, Cr(III), Fe(II), H2, Cu, Ag, Hg, Au. Каждый металл вытесняет из растворов солей металлы, стоящие справа от него; металлы, которые расположены левее Н2, вытесняют его из кислот.
Ряд напряжений
(реже - ряд активностей)
последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов (См. Электродный потенциал) в растворах электролитов. Электродом сравнения обычно служит стандартный Водородный электрод. Поэтому в Р. н. включают и водород, электродный потенциал которого принимается равным нулю. В СССР и многих других европейских странах электродному потенциалу принято давать знак, одинаковый со знаком заряда электрода из данного металла по отношению к стандартному водородному электроду (в США принято давать обратный знак). Наибольшие отрицательные потенциалы характерны для щелочных металлов (около - 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы (около + 1,5 в; численные значения см. в ст. Металлы, табл. 2 и 3). В Р. н. часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые металлы расположены в Р. н. в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au (см. там же).
Место каждого элемента в Р. н. несколько условно, так как величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от активности (или концентрации) ионов данного вещества в электролите. Большое значение имеет состояние поверхности электрода (гладкая, шероховатая), в особенности наличие на ней окисной защитной плёнки (см. Пассивирование). Р. н., обычно, приводимый в учебной литературе, относится к водным растворам при температуре 25 °С, давлении газов 1 атм и при активности ионов, участвующих в электрохимической реакции, равной 1. При изменении концентраций и растворителя последовательность веществ в Р. н. может изменяться, особенно для веществ, близко расположенных в этом ряду.
Важнейшие следствия, вытекающие из Р. н. и широко используемые в химической практике: 1) каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие в Р. н. правее данного металла; 2) все металлы, расположенные в Р. н. левее водорода, способны вытеснять его из кислот; 3) чем дальше расположены друг от друга два металла в Р. н., тем большее напряжение может давать построенный из них гальванический элемент. Р. н. составляется на основе термодинамических характеристик электрохимических процессов, поэтому он позволяет судить лишь о принципиальной возможности этих процессов; реальное же их осуществление во многом определяется кинетическими факторами.
Лит.: Курс физической химии (под общ. ред. Я. И. Герасимова), т. 2, 2 изд., М., 1973, гл. 20; Полинг Л., Общая химия, пер. с англ., М., 1974, гл. XV.
М. Е. Ерлыкина.
Электрохимический ряд активности металлов
Электрохимический ряд активности металлов (ряд напряжений, ряд (вытеснения) Бекетова, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов E0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Тензор напряжений
ТЕНЗОР ВТОРОГО РАНГА, КОМПОНЕНТЫ КОТОРОГО - МЕХАНИЧЕСКИЕ НАПРЯЖЕНИЯ
Тензор напряжений Коши; Тензор натяжений
Те́нзор напряже́ний (иногда тензор напряжений Коши, тензор натяжений) — тензор второго ранга, описывающий механические напряжения в произвольной точке нагруженного тела, возникающих в этой точке при его (тела) малых деформациях. В случае объёмного тела, тензор часто записывается в виде матрицы 3×3:
Сходящийся ряд
ПОНЯТИЕ В МАТЕМАТИЧЕСКОМ АНАЛИЗЕ
Сумма ряда; Бесконечная сумма; Ряд матриц; Числовые ряды; Критерий абсолютной сходимости суммы числовых рядов; Критерий абсолютной сходимости; Сходимость ряда; Сходящийся ряд; Расходящийся ряд; Суммируемость; Частичная сумма; Частичные суммы; Частичная сумма ряда; Числовой ряд
см. Ряд.
Расходящийся ряд
ПОНЯТИЕ В МАТЕМАТИЧЕСКОМ АНАЛИЗЕ
Сумма ряда; Бесконечная сумма; Ряд матриц; Числовые ряды; Критерий абсолютной сходимости суммы числовых рядов; Критерий абсолютной сходимости; Сходимость ряда; Сходящийся ряд; Расходящийся ряд; Суммируемость; Частичная сумма; Частичные суммы; Частичная сумма ряда; Числовой ряд
ряд, у которого последовательность частичных сумм не имеет конечного предела. Если общий член ряда не стремится к нулю, то ряд расходится, например 1 - 1 + 1 - 1 + ... + (-1) n-1 + ...; примером Р. p., общий член которого стремится к нулю, может служить гармонический ряд 1 + 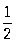 + ...+
+ ...+ 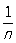 +.... Существуют многочисленные классы Р. р., сходящихся в том или ином обобщённом смысле, так что каждому такому Р. р. можно приписать некоторую "обобщённую сумму", обладающую важнейшими свойствами суммы сходящегося ряда. См. Ряд, Суммирование расходящихся рядов и интегралов.
+.... Существуют многочисленные классы Р. р., сходящихся в том или ином обобщённом смысле, так что каждому такому Р. р. можно приписать некоторую "обобщённую сумму", обладающую важнейшими свойствами суммы сходящегося ряда. См. Ряд, Суммирование расходящихся рядов и интегралов.
Тейлора ряд
РАЗЛОЖЕНИЕ ФУНКЦИИ В БЕСКОНЕЧНУЮ СУММУ СТЕПЕННЫХ ФУНКЦИЙ
Ряд Маклорена; Формула Тейлора; Ряды Тейлора; Многочлен Тейлора; Тейлора формула; Тейлора ряд; Маклорена ряд; Формула Маклорена; Ряд Тэйлора; Формула Тэйлора; Ряд Маклорена.
Степенной ряд вида
, (1)
где f (x) - функция, имеющая при х = а производные всех порядков. Во многих практически важных случаях этот ряд сходится к f (x) на некотором интервале с центром в точке а:
(2)
(эта формула опубликована в 1715 Б. Тейлором). Разность Rn (x) = f (x) - Sn (x), где Sn (x) - сумма первых n + 1 членов ряда (1), называется остаточным членом Т. р. Формула (2) справедлива, если 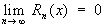 . Т. р. можно представить в виде
. Т. р. можно представить в виде
,
применимом и к функциям многих переменных.
При а = 0 разложение функции в Т. р. (исторически неправильно называемый в этом случае рядом Маклорена; см. Маклорена ряд) принимает вид:
,
в частности:
(3)
(4)
(5)
(6)
.(7)
Ряд (3), являющийся обобщением на случай дробных и отрицательных показателей формулы бинома Ньютона, сходится: при -1< х < 1, если m < -1; при -1< x ≤ 1, если -1< m < 0; при -1 ≤ x ≤ 1, если m > 0. Ряды (4), (5) и (6) сходятся при любых значениях х, ряд (7) сходится при -1< x ≤ 1.
Функция f (z) комплексного переменного z, регулярная в точке а, раскладывается в Т. р. по степеням z - а внутри круга с центром в точке я и с радиусом, равным расстоянию от а до ближайшей особой точки функции f (z). Вне этого круга Т. р. расходится, поведение же его на границе круга сходимости может быть весьма сложным. Радиус круга сходимости выражается через коэффициенты Т. р. (см. Радиус сходимости).
Т. р. является мощным аппаратом для исследования функций и для приближённых вычислений. См. также Тейлора формула.
Лит.: Хинчин А. Я., Краткий курс математического анализа, М., 1953; Фихтенгольц Г. М., Курс дифференциального и интегрального исчисления, 7 изд., т. 2, М., 1969.
Ряд (математика)
ПОНЯТИЕ В МАТЕМАТИЧЕСКОМ АНАЛИЗЕ
Сумма ряда; Бесконечная сумма; Ряд матриц; Числовые ряды; Критерий абсолютной сходимости суммы числовых рядов; Критерий абсолютной сходимости; Сходимость ряда; Сходящийся ряд; Расходящийся ряд; Суммируемость; Частичная сумма; Частичные суммы; Частичная сумма ряда; Числовой ряд
Ряд, называемый также бесконечная сумма — одно из центральных понятий математического анализа. В простейшем случае ряд записывается как бесконечная сумма чисел:
МАКЛОРЕНА РЯД
РАЗЛОЖЕНИЕ ФУНКЦИИ В БЕСКОНЕЧНУЮ СУММУ СТЕПЕННЫХ ФУНКЦИЙ
Ряд Маклорена; Формула Тейлора; Ряды Тейлора; Многочлен Тейлора; Тейлора формула; Тейлора ряд; Маклорена ряд; Формула Маклорена; Ряд Тэйлора; Формула Тэйлора; Ряд Маклорена.
(по имени К. Маклорена), частный случай Тейлора ряда.
Маклорена ряд
РАЗЛОЖЕНИЕ ФУНКЦИИ В БЕСКОНЕЧНУЮ СУММУ СТЕПЕННЫХ ФУНКЦИЙ
Ряд Маклорена; Формула Тейлора; Ряды Тейлора; Многочлен Тейлора; Тейлора формула; Тейлора ряд; Маклорена ряд; Формула Маклорена; Ряд Тэйлора; Формула Тэйлора; Ряд Маклорена.
исторически неправильное название (по имени К. Маклорена) степенного ряда вида:
,
где f(0), f'(0), f"(0), ..., f(n)(0),... - значения заданной функции f(x) и её последовательных производных при х = 0. Этот ряд был получен ранее Маклорена английским математиком Б. Тейлором (опубликовал 1715), что было известно и самому Маклорену. М. р. есть частный случай Тейлора ряда.
Википедия
Электрохимический ряд активности металлов
Электрохимический ряд активности металлов (ряд напряжений, ряд (вытеснения) Бекетова, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов E0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.

![стандартного электрохимического потенциала]]) стандартного электрохимического потенциала]])](https://commons.wikimedia.org/wiki/Special:FilePath/Reactivity metals in dilute sulfuric acid.png?width=200)

